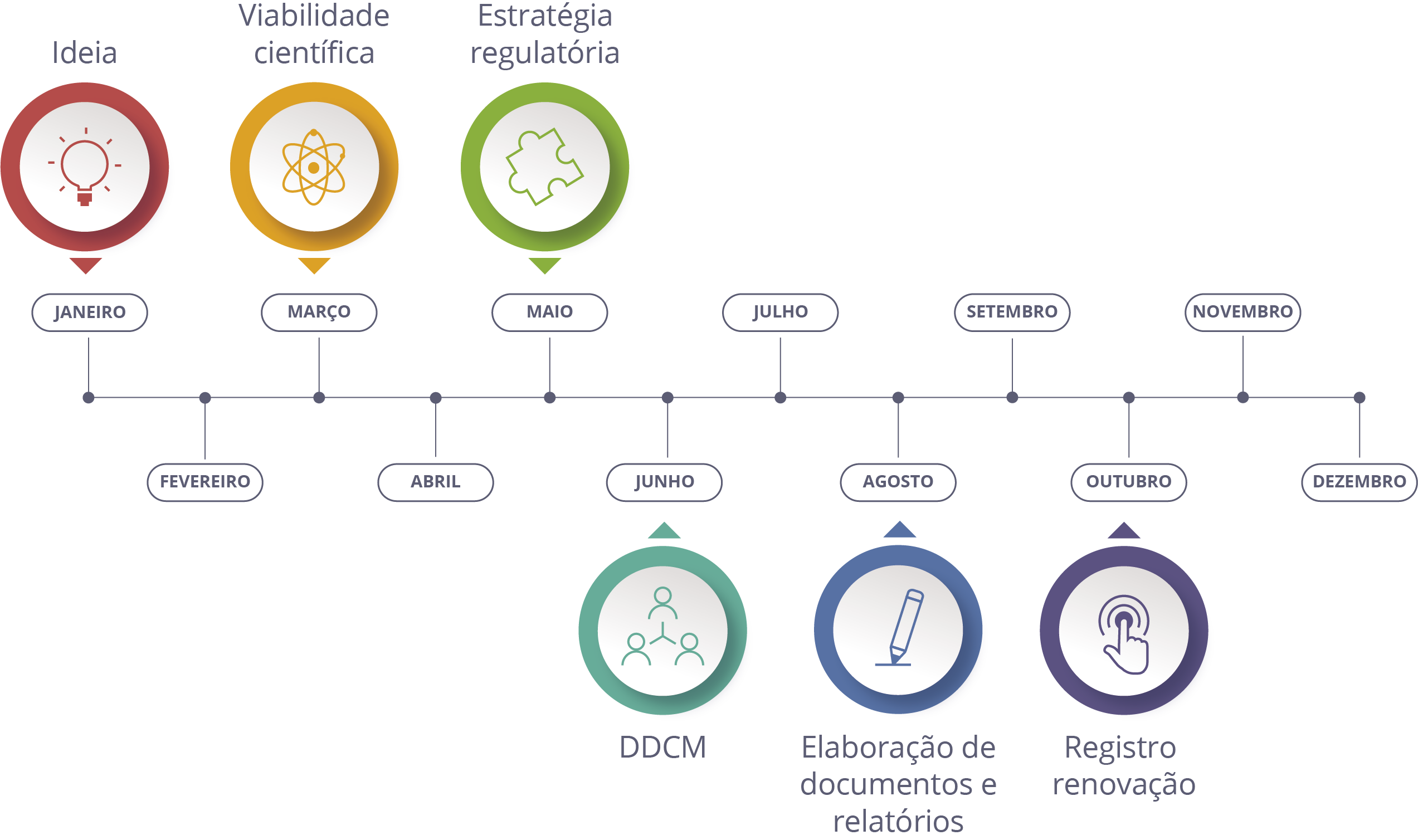
Avaliação para identificar a adequação às normas regulatórias
⦁ Estudos de bioequivalência;
⦁ Documentação para submissão de registro de medicamento (avaliação regulatória e/ou técnica);
⦁ Protocolos de pesquisa clínica;
⦁ Protocolos de bioequivalência;
⦁ Estatística de estudos clínicos e de bioequivalência conduzidos no Brasil e no exterior.
Consultoria e assessoria técnica e regulatória
⦁ Definição da estratégia e suporte regulatório para o registro e pós-registros de medicamentos na América Latina (especialmente Brasil) e Europa;
⦁ Resposta de exigências;
⦁ Defesa técnica junto a ANVISA.
Elaboração de conteúdos técnico-científicos
⦁ Redação científica (artigos científicos, projetos de pesquisa, comunicação médico-científica para materiais promocionais);
⦁ Redação de patentes de medicamentos;
⦁ Brochura do investigador;
⦁ Protocolos de pesquisa clínica;
⦁ Protocolos de estudo de bioequivalência;
⦁ DDCM - Dossiê de Desenvolvimento Clínico de Medicamentos;
⦁ Dossiê para avaliação de probióticos para uso em alimento;
⦁ Relatórios técnico-científicos:
- Eficácia e segurança;
- Farmacocinética linear para bioisenção;
- Interações medicamentosas;
- Interações farmacocinéticas;
- Estudos não clínicos de toxicidade e eficácia;
- Suplementos alimentares;
⦁ Confecção de bulas.
Monitoria em estudos de bioequivalência farmacêutica
Habilitada para atuar de acordo com as normas de Boas Práticas Clínicas (ICH - GCP) e em conformidade com as diretrizes próprias POPs (Procedimentos Operacionais Padrão), assegurando que o estudo clínico é conduzido, registrado e relatado em conformidade com o protocolo clínico.
Inovação
Pesquisa em literatura científica visando a busca de:
⦁ Novas associações com potencial terapêutico;
⦁ Novas indicações terapêuticas;
⦁ Tecnologias de liberação de fármacos mais eficazes do que as existentes.
Avaliação para identificar a adequação às normas regulatórias
⦁ Estudos de bioequivalência
⦁ Documentação para submissão de registro de medicamento (avaliação regulatória e/ou técnica);
⦁ Protocolos de pesquisa clínica;
⦁ Protocolos de bioequivalência;
⦁ Estatística de estudos clínicos e de bioequivalência conduzidos no Brasil e no exterior.
Consultoria e assessoria técnica e regulatória
⦁ Definição da estratégia e suporte regulatório para o registro e pós-registros de medicamentos na América Latina (especialmente Brasil) e Europa;
⦁ Resposta de exigências;
⦁ Defesa técnica junto a ANVISA.
Elaboração de conteúdos técnico-científicos
⦁ Redação científica (artigos científicos, projetos de pesquisa, comunicação médico-científica para materiais promocionais);
⦁ Redação de patentes de medicamentos;
⦁ Brochura do investigador;
⦁ Protocolos de pesquisa clínica;
⦁ Protocolos de estudo de bioequivalência.
⦁ DDCM - Dossiê de Desenvolvimento Clínico de Medicamentos;
⦁ Dossiê para avaliação de probióticos para uso em alimento;
⦁ Relatórios técnico-científicos:
- Eficácia e segurança;
- Farmacocinética linear para bioisenção;
- Interações medicamentosas;
- Interações farmacocinéticas;
- Estudos não clínicos de toxicidade e eficácia;
- Suplementos alimentares.
⦁ Confecção de bulas.
Monitoria em estudos de bioequivalência farmacêutica
Habilitada para atuar de acordo com as normas de Boas Práticas Clínicas (ICH - GCP) e em conformidade com as diretrizes próprias POPs (Procedimentos Operacionais Padrão), assegurando que o estudo clínico é conduzido, registrado e relatado em conformidade com o protocolo clínico.
Inovação
Pesquisa em literatura científica visando a busca de:
⦁ Novas associações com potencial terapêutico;
⦁ Novas indicações terapêuticas;
⦁ Tecnologias de liberação de fármacos mais eficazes do que as existentes.














































